На сегодняшний день около 4 млн пациентов в США принимают пероральную антикоагулянтную терапию. Она показана как для профилактики инсульта у пациентов с ФП, так и для профилактики и лечения ВТЭО.
Около 20% принимающих ПОАК ежегодно подвергаются плановым или неотложным хирургическим манипуляциям (операция, как правило, с общей/спинальной анестезией) или нехирургическим процедурам (например, биопсия или колоноскопия) [1,2].
От специалистов часто требуется принятие решения о предоперационном прерывании и возобновлении ПОАК в послеоперационном периоде, чтобы свести к минимуму риск тромбоэмболии и кровотечения.
В статье « anagement of Patients Taking Direct OralAnticoagulants: A Review M» [3] обобщены современные данные, касающиеся проведения терапии ПОАК у пациентов, проходящих плановую, экстренную, срочную или полусрочную хирургическую или нехирургическую процедуру.
В обзор было включено 99 статей, включающих 26 клинических испытаний, 30 ретроспективных обсервационных исследований, 28 систематических или описательных обзоров и 15 руководств по клинической практике.
Механизмы действия и клиническая фармакология ПОАК
Период полувыведения прямых пероральных антикоагулянтов важен для планирования хирургических и иных процедур, так как он определяет временной интервал, необходимый для минимизации антикоагулянтного эффекта.
Так, период полувыведения ингибиторов фактора Ха (апиксабан, ривароксабан, эдоксабан) составляет примерно 8–12 часов у пациентов с клиренсом креатинина >30 мл/мин. Дабигатран, напротив, сильнее зависит от функции почек: его период полувыведения равен 10–14 часам при клиренсе креатинина ≥50 мл/мин и увеличивается до 18–24 часов при снижении клиренса до 30–49,9 мл/мин.
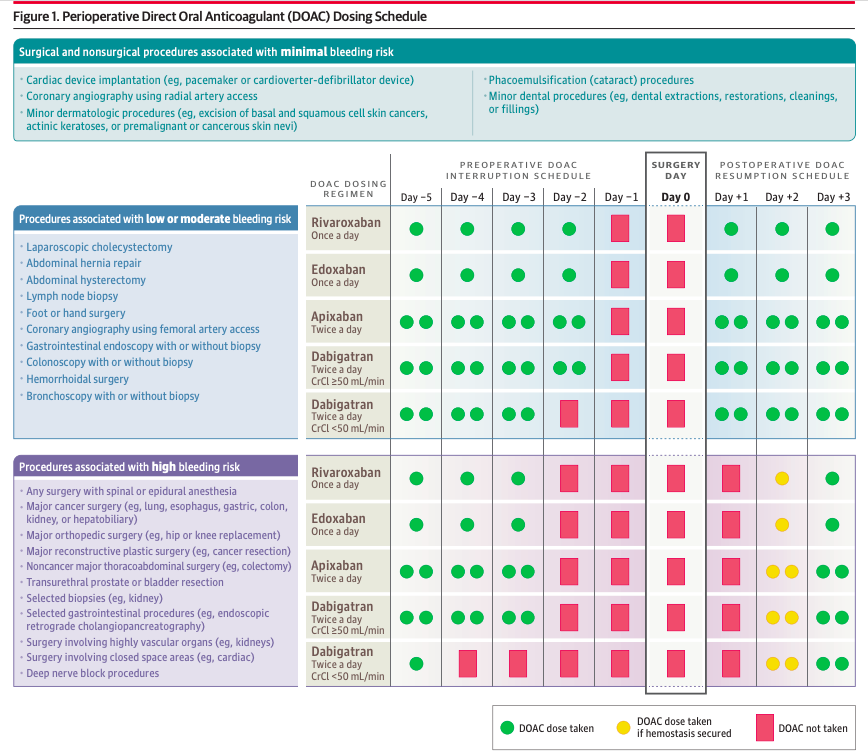
При выборе стратегии для периоперационного ведения ПОАК при плановых вмешательствах необходимо разделить риск кровотечения на минимальный, умеренный и высокий. Следует также учитывать другие факторы, такие как кровотечения в анамнезе и активный рак.
Плановые процедуры с минимальным риском кровотечения
(имплантация сердечных устройств, коронарная ангиография через лучевую артерию, малые дерматологические процедуры, факоэмульсификация, малые стоматологические процедуры).
• Рекомендуется продолжение приема ПОАК в периоперационном периоде.
Исследование 846 пациентов после катетерной абляции при неклапанной фибрилляции предсердий показало, что частота симптомных ВТЭО и серьезных кровотечений составила 0,7% среди продолжавших прием ПОАК и 1,2% среди прекративших (p = 0,48) [4].
У 737 пациентов с имплантированными кардиостимуляторами, кардиовертер-дефибрилляторами или абляцией атриовентрикулярного узла частота гематом и серьезных кровотечений при продолжении приема ПОАК составляла от 1,3% до 2,1%. [4].
Ретроспективное когортное исследование с участием 112 пациентов показало, что продолжение приема ПОАК перед небольшими кожными процедурами не увеличило частоты серьезных кровотечений [5].
Мета-анализ 988 пациентов с небольшими стоматологическими процедурами не показал увеличения серьезных кровотечений при продолжении приема ПОАК [6,7].
В ретроспективных исследованиях, включавших 114 пациентов, продолжавших прием ПОАК перед операцией факоэмульсификации, выполненных под местной анестезией, частота кровотечений составила от 0% до 1,8% [8].
Плановые процедуры с умеренным риском кровотечения
(лапароскопическая холецистэктомия, абдоминальная герниопластика, абдоминальная гистерэктомия, биопсия лимфатического узла, хирургия стопы и кисти, ангиография, через бедренную артерию, ФГДС, ФКС , бронхоскопия, хирургия геморроидальных л/узлов)
• Следует прекратить прием ПОАК за 1 день до процедуры, что соответствует 30-36-часовому интервалу (приблизительно 3 периода полувыведения) между приемом последней дозы и процедурой.
Плановые процедуры с высоким риском кровотечения
(любая хирургия со спинальной или эпидуральной анестезией, онкологические операции, ортопедические операции, реконструктивные пластические операции, торакоабдоминальные операции, трансуретральная резекция мочевого пузыря или простаты, селективные биопсии, селективные гастроинтестинальные процедуры, операции на хорошо васкуляризированных органах, операции на ограниченных полостях)
• У ингибиторов фактора Ха (апиксабан, ривароксабан, эдоксабан) и дабигатрана (у пациентов с КК 50 мл/мин или выше) требуется 2-дневный период прекращения приема перед операцией, который соответствует интервалу от 60 до 68 часов (приблизительно 5 периодов полураспада) между приемом последней дозы и проведением процедуры.
• У дабигатрана (у пациентов с КК менее 50 мл/мин) прекращение приема еще на 1 дополнительный день перед операцией с низким или умеренным риском и еще на 2 дня перед хирургическим вмешательством с высоким риском кровотечения.
Возобновление послеоперационного приема ПОАК
Сроки возобновления в послеоперационном периоде зависят от риска кровотечения и оценки гемостаза в месте операции, включая потерю крови при перевязках и дренажах в месте операции.
В исследовании PAUSЕ ПОАК были возобновлены не ранее, чем через 24 часа при умеренном риске и через 48-72 часа после процедур с высоким риском.
Исследование PAUSE показало, что пациенты, перенесшие хирургические или нехирургические процедуры с высоким риском кровотечения и венозной тромбоэмболии, могут получать профилактическую дозу низкомолекулярного гепарина (НМГ) (например, дальтепарин 5000 МЕ в день или эноксапарин 40 мг в день) в течение 1-3 дней перед возобновлением приема ПОАК.
Измерение уровня ПОАК в периоперационном периоде
Безопасный уровень ПОАК для проведения операций не установлен. Уровень <50 нг/мл можно считать минимальным, клинически незначимым АК-эффектом, а уровень <30 нг/мл можно считать неопределяемым АК-эффектом.
Субанализ PAUSE не выявил существенной связи между предоперационными уровнями ПОАК (<30 нг/мл, 30-50 нг/мл или >50 нг/мл) и периоперационным сильным или незначительным кровотечением [9].
Периоперационная мост-терапия
Не рекомендуется применять гепариновую мост-терапию во время периоперационного прерывания ПОАК, поскольку такая практика увеличивает риск кровотечения, что может задержать возобновление антикоагулянтной терапии и, таким образом, потенциально увеличить риск артериальной тромбоэмболии [10,11].
У пациентов, получавших ПОАК, которым требовалась плановая операция/процедура, применение НМГ было связано с повышенным риском развития кровотечения по сравнению с отсутствием перекрытия (6,8% против 1,8%; р < 0,001) и не снижал риск артериальной тромбоэмболии (0,5% против 0,3%; P = 0,46) [12].
Пациентам, перенесшим операцию, при высоком риске кровотечения и ВТЭО вводятся профилактические дозы НМГ в течение суток после операции и продолжаются 2-3 дня до возобновления приема ПОАК.
Пациенты, проходящие нейроаксиальную (спинномозговую или эпидуральную) анестезию.
• Отмена ПОАК за 3 дня до операции, если пациенты принимают апиксабан, эдоксабан или ривароксабан.
• Отмена ПОАК за 4 дня до операции, если пациенты принимают дабигатран.
Сводится к минимуму риск эпидурального кровоизлияния, которое может привести к параличу нижних конечностей. Эти рекомендации также применимы к пациентам, которым проводятся эпидуральные инъекции стероидов и блокада симпатических ганглиев.
Пациенты, проходящие стоматологические процедуры.
Удаление зубов и эндодонтические процедуры могут вызывать кровотечение. Чтобы минимизировать его, не следует принимать ПОАК в день процедуры. Необходимо обеспечить компрессию в месте процедуры. Плюс — полоскание рта раствором транексамовой кислоты (500 мг на 5-10 мл воды) 3-4 раза в день.
Пациенты с нарушением функции почек.
Имеются ограниченные данные о фармакокинетике и сроках прекращения приема препарата перед операцией у пациентов с тяжелой почечной недостаточностью (КК, 15-29 мл/мин) или конечными стадия ХПН (КК <15 мл/мин).
Пациентам с клиренсом креатинина менее 30 мл/мин перед операцией рекомендуется продлить перерыв в приеме ПОАК на 3-4 дня вместо 2 дней. Дабигатран противопоказан при клиренсе креатинина менее 30 мл/мин.
Пациенты, проходящие эндоскопическое исследование.
Процедуры, такие как удаление большого полипа (> 1 см) или панкреатография со сфинктеротомией, сопряжены с высоким риском кровотечения и требуют перерыва в приеме ПОАК на 1 день до и 1-2 дня после процедуры, что в сумме составляет 4-5 дней перерыва.
Антикоагулянтный эффект ПОАК может быть нейтрализован специфическими препаратами: андексанет-α для апиксабана, эдоксабана и ривароксабана, а также идаруцизумаб для дабигатрана. Неспецифический прогемостатический препарат — концентрат протромбинового комплекса — также может устранить эффект всех ПОАК.
В одноцентровом ретроспективном исследовании, в котором приняли участие 44 пациента, принимавших ПОАК до поступления (27 [62,8%] апиксабан и 16 [37,2%] ривароксабан), сообщалось, что у 30 (78,9%) пациентов в течение 24 часов наблюдался удовлетворительный гемостаз, через несколько часов после перипроцедурного введения андексанета-α [13].
В когортном исследовании сообщалось о результатах лечения 84 пациентов, принимавших ривароксабан или апиксабан, у которых было сильное кровотечение, потребовавшее срочного вмешательства, и которые получили концентрат протромбинового комплекса (КПК). КПК был признан эффективным у 58 (69,1%) пациентов и неэффективен у 26 (30,9%) пациентов, из которых
у 16 (61,5%) произошло внутримозговое кровоизлияние, у 2 пациентов развился ишемический инсульт [14].
Тактика при неотложной хирургии.
( при возможности определения анти-фактора Ха (нг/мл) для апиксабана, ривароксабана, эдоксабана и тромбинового времени (сек) для дабигатрана).
◦ Экстренные операции (в течении 6 часов).
- <50 нг/мл; <50 сек -проведение операции.
- >50 нг/мл или уровень ПОАК неизвестен — прием антагонистов ПОАК, проведение операции.
◦ Срочные операции (6-24ч).
- <50 нг/мл, <50 сек — проведение операции.
- >50 нг/мл — повторный анализ через 8-12ч, если <50 нг/мл — проведение операции, >50 нг/мл прием антагонистов ПОАК, проведение операции.
- уровень ПОАК неизвестен — прием антагонистов ПОАК, если последний прием препарата был менее 48ч, проведение операции.
◦ Полусрочные операции(25-48ч).
- <50нг/мл, <50 сек — проведение операции.
- >50 нг/мл или уровень ПОАК неизвестен — ожидание 48ч, проведение операции.
Заключение
Данный обзор помог привести в единое целое всю информацию, которая касается периооперационного ведения пациентов на антикогулянтах. Представленная авторами таблица дает очень наглядное представление о том, как поступить с АКТ, в зависимости от планируемого вмешательства. Но в своей работе я не сталкивалась с рутинным определением Анти-фактора Ха или применением антагонистов ПОАК перед экстренным вмешательством. Применяется ли такая практика в стационарах — интересно узнать мнение хирургов.
Список литературы.
1. Spyropoulos AC, Al-Badri A, Sherwood MW, Douketis JD. Periprocedural management of patients receiving a vitamin K antagonist or a direct oral anticoagulant requiring an elective procedure or surgery.J Thromb Haemost. 2016;14(5):875-885. doi:10.1111/jth.13305
2. Douketis JD, Spyropoulos AC, Murad MH, et al. Perioperative management of antithrombotic therapy: an American College of Chest Physicians clinical practice guideline. Chest. 2022;162(5):e207- e243. doi:10.1016/j.chest.2022.07.025
3. Douketis JD, Spyropoulos AC. Perioperative Management of Patients Taking Direct Oral Anticoagulants: A Review. JAMA. 2024 Sep 10;332(10):825-834. doi: 10.1001/jama.2024.12708. Erratum in: JAMA. 2024 Oct 15;332(15):1306. doi: 10.1001/jama.2024.20028. PMID: 39133476.
4. Nakamura K, Naito S, Sasaki T, et al. Uninterrupted vs. interrupted periprocedural direct oral anticoagulants for catheter ablation of atrial fibrillation: a prospective randomized single-centre study on post-ablation thrombo-embolic andhaemorrhagic events. Europace. 2019;21(2):259-267. doi:10.1093/europace/euy148
5. Sheikh MA, Kong X, Haymart B, et al. Comparison of temporary interruption with continuation of direct oral anticoagulants for low bleeding risk procedures. Thromb Res. 2021;203: 27-32.doi:10.1016/j.thromres.2021.04.006
6. López-Galindo M, Grau-Benítez M. Systematic review on the effects of the discontinuation of the anticoagulant therapy and the postoperative bleeding, in patients under new oral anticoagulants after dental extraction.J Clin Exp Dent. 2023;15(4): e338-e345. doi:10.4317/jced.60122
7. Hua W, Huang Z, Huang Z. Bleeding outcomes after dental extraction in patients under direct-acting oral anticoagulants vs. vitamin K antagonists: a systematic review and meta-analysis. Front Pharmacol. 2021;12:702057. doi:10.3389/ fphar.2021.702057
8. Barequet IS, Zehavi-Dorin T, Bourla N, Tamarin I, MoisseievJ, Salomon O. Safety of cataract surgery in patients treated with the new oral anticoagulants (NOACs). Graefes Arch Clin Exp Ophthalmol. 2019; 257(12):2671-2676. doi:10.1007/s00417-019- 04488-8
9. Tafur AJ, Clark NP, Spyropoulos AC, et al. Predictors of bleeding in the Perioperative Anticoagulant Use for Surgery Evaluation study. J Am Heart Assoc. 2020;9(19):e017316. doi:10.1161/ JAHA.120.017316
10. Douketis JD, Hasselblad V, Ortel TL. Bridging anticoagulation in patients with atrial fibrillation. N Engl J Med. 2016;374(1):93-94. doi:10.1016/j.jvs. 2015.11.010
11. Nazha B, Pandya B, Cohen J, et al. Periprocedural outcomes of direct oral anticoagulants versus warfarin in nonvalvular atrial fibrillation. Circulation. 2018;138(14):1402-1411. doi:10.1161/CIRCULATIONAHA.117.031457
12.Douketis JD,Healey JS, Brueckmann M,etal. Perioperative bridging anticoagulation during dabigatran or warfarin interruption among patients who had anelective surgery or procedure. Thromb Haemost.2015;113(3):625-632.doi:10.1160/TH14-04-0305
13. Godon A, Gabin M, Levy JH, etal; GIHP-NACO StudyGroup.Management of urgentinvasive procedures in patients treated with direct oral anticoagulants: an observational registry analysis. Thromb Res.2022;216:106-112.doi:10.1016/j.thromres.2022.06.005
14. MajeedA,ÅgrenA,HolmströmM,etal. Management of rivaroxaban-orapixaban-associated major bleeding with prothrombin complex concentrates: a cohort study.Blood.2017; 130(15):1706-1712.doi:10.1182/blood-2017-05-782060