ВТЭО играют большое значение в клинической практике в связи с высоким риском для здоровья и жизни пациента. С данным состоянием может столкнуться врач любой специальности. В связи с этим возникает вопрос: что следует предпринять для его диагностики, профилактики и лечения? Лечить в стационаре или амбулаторно?. В качестве ответа на данные вопросы представляем обзорную статью «Martin H. Ellis MD, Orly Avnery MD. Decision making in the management of veous thromboembolism» [1]. В этой работе авторы используют сценарии случаев для обоснования решений в клинической практике. Опубликованные руководства также содержат информацию о безопасном амбулаторном лечении ВТЭО.
Случай № 1: Диагноз
У 66-летней женщины в течение 3 дней беспокоила боль в левой икре. Травмы, повышение температуры тела отрицает. Она много курит и две недели назад лежала в больнице с обострением ХОБЛ. Из-за одышки оставалась дома с момента выписки. При осмотре – варикозное расширение вен н/конечностей с изменениями кожи и отеком левой ноги до середины бедра.
Диагноз ВТЭО подтверждается при инструментальном исследовании: УЗДГ сосудов, КТ-флебографии или МРТ вен в случае ТГВ и КТ-ангиографии или сцинтиграфии для выявления легочной эмболии. Венозную тромбоэмболию можно исключить у большинства пациентов с низким клиническим баллом вероятности по шкале Уэллса и Женева у которых диагноз изначально рассматривался из-за общих симптомов (отека ног или кашля и боли в груди). У пациентов со средним баллом вероятности следует измерять уровень Д-димера. Его повышение увеличивают вероятность венозной тромбоэмболии. У таких пациентов и у пациентов с высоким клиническим баллом вероятности выполняется инструментальное исследование для подтверждения или исключения ВТЭО. Алгоритм, основанный на этих принципах, показан на рисунке. Он дает возможность безопасно избежать необходимость дополнительных методов исследования почти у всех надлежащим образом отобранных пациентов.
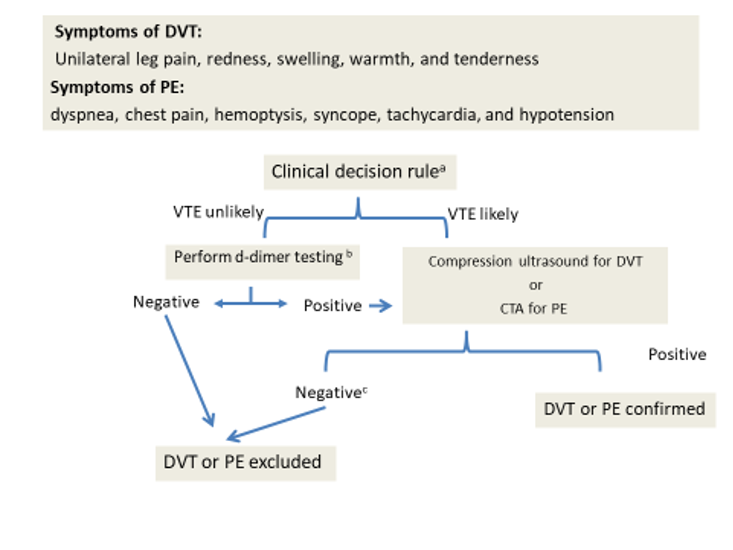
У данной пациентки промежуточная вероятность ТГВ с использованием как шкалы Уэллса (1 балл), по Женевской шкале (4 балла). Ей следует измерить уровень Д-димера, и если он повышен (с поправкой на возраст), то необходимо провести УЗДГ вен нижних конечностей. Если Д-димер нормальный, ТГВ можно исключить с 97% уверенностью.
Метаанализ РКИ низкомолекулярного гепарина (НМГ), опубликованный более 10 лет назад, продемонстрировал клиническую пользу профилактики венозной тромбоэмболии у стационарных пациентов и был принят в качестве стандарта лечения пациентов с высоким риском венозной тромбоэмболии ( шкала Падуа ). В качестве препарата выбора при профилактике ВТЭО НМГ и ПОАК имеют одинаковую клиническую пользу, поэтому использование любого из них приемлемо. Нет однозначных рекомендаций по продлению профилактики амбулаторно поскольку, ее влияние на общую смертность не определено, а вероятность клинически значимых кровотечений увеличивается.
Случай № 2: Первичная антикоагуляция
42-летний мужчина поступил в отделение неотложной помощи с одышкой, плевритической болью в груди и периодическим кровохарканьем в течение 36 часов. В анамнезе системная красная волчанка от которой он получает гидроксихлорохин. Он сообщил о 10-часовом перелете на самолете за 3 недели до обращения. При осмотре АД 140/85 мм рт. ст., ЧСС — 110 в минуту, а сатурация кислорода — 90%. КТ-ангиография показала двусторонние сегментарные дефекты наполнения — ТЭЛА.
Антикоагулянтная терапия должна быть начата немедленно после диагностики венозной тромбоэмболии при отсутствии абсолютных противопоказаний. Когда рассматривается системный тромболизис при массивной ТЭЛА с кардиогенным шоком или локальный тромболизис при обширном проксимальном тромбозе глубоких вен, антикоагуляцию откладывают до проведения литической терапии. За исключением этих случаев в настоящее время рекомендуется лечение с помощью ПОАК, которое назначается после постановки диагноза. Важным исключением является венозная тромбоэмболия у пациентов с антифосфолипидным синдромом, у которых присутствуют положительные тесты на волчаночный антикоагулянт, кардиолипин и антитела к бета 2 гликопротеину 1. Эти пациенты подвергаются тройному риску рецидивирующего тромбоза, как венозного, так и артериального, при получении ривароксабана по сравнению с АВК (антагонисты витамина К). Т.е., ПОАК не рекомендуются при тройном положительном антифосфолипидном синдроме. Решение о госпитализации зависит от клинического состояния пациента, доступа к постоянной медицинской помощи и социальной поддержке. Недавние исследования показали, что большинство пациентов с ТГВ можно безопасно лечить в амбулаторных условиях. Пациенты с ТЭЛА, имеющие низкий риск кардиореспираторной декомпенсации, могут рассматриваться для амбулаторного лечения.Для оценки возможности амублаторного лечения используются Шкала PESI и упрощенная шкала PESI. Пациенты с очень низким (класс PESI 1) или низким (класс PESI 2) баллом могут лечиться амбулаторно.
У данного пациента промежуточный балл PESI, и поэтому его следует госпитализировать. Наличие у него СКВ увеличивает вероятность наличия антифосфолипидных антител. Поэтому первоначальное лечение НМГ (например, эноксапарином в дозе 1,5 мг/кг/день) с последующим приемом АВК следует рассматривать как более предпочтительное, чем ПОАК. Если впоследствии исключат антифосфолипидный синдром, можно использовать ПОАК.
Случай № 3: Исследование этиологии
28-летняя женщина обратилась с отеком левой ноги. Она в целом здорова и принимает комбинированные оральные контрацептивы в течение 5 лет. У нее было два выкидыша в первом триместре. У тети была послеродовая ТЭЛА. По УЗДГ — тромбоз бедренной вены. Начата терапия ПОАК. Через три месяца лечения ее направляют к гематологу на консультацию.
После достижения симптоматического улучшения следует рассмотреть вопрос об определении этиологии ВТЭО. Это важно не только для пациентов, которые ищут объяснение события, но и для определения стратегии долгосрочного лечения. Этиологию ВТЭО можно определить, пользуясь триадой Вирхова: изменения в кровотоке (стаз), повреждение сосудов и гиперкоагуляция крови (тромбофилия). Тромбогенные факторы, такие как травма, хирургическое вмешательство, иммобилизация, недавнее начало использования КОК, беременность или злокачественное новообразование, могут быть очевидны при поступлении. В этом случае венозная тромбоэмболия классифицируется как спровоцированная. Дальнейшая оценка может выявить скрытый рак (у 10% пациентов, особенно среди пожилых людей), и тогда событие классифицируется как тромбоз, связанный с раком. Также может быть полезным тестирование на наследственную или приобретенную тромбофилию. Эти тесты не показаны при спровоцированном или связанном с раком тромбозе. Наследственные тромбофилии следует подозревать у пациентов с семейным анамнезом ВТЭО в возрасте <40 лет или рецидивирующей ВТЭО. Хотя руководства не рекомендуют проводить рутинный скрининг на наследственные тромбофилии у членов семьи, существуют обстоятельства, при которых это может быть показано.
У данной пациентки в анамнезе есть выкидыши, которые могут быть связаны тромбофилиями и семейным анамнезом ВТЭО, а также длительный прием КОКов. По отдельности эти факторы не имеют высокой корреляции с тромбофилией, но вместе должны вызывать подозрение на нее. Результаты обследований могут определять длительность антикоагулянтной терапии. Поскольку пациентка долго принимает КОКи, этот фактор может считаться незначительным. Результаты обследований не повлияют на решения относительно профилактики во время воздействия высокого риска в будущем, например, беременности или хирургического вмешательства, поскольку тромбопрофилактика уже показана из-за предыдущего ТГВ. Тесты на наследственную тромбофилию могут быть важны для консультирования других родственниц первой степени родства в ее семье относительно использования КОК и беременности. Наличие антифосфолипидных антител определит выбор антикоагулянта.
Случай № 4: Продленная антикоагуляция
56-летняя женщина с метастатическим раком молочной железы направлена на консультацию по поводу текущего лечения антикоагулянтами. Ей поставили диагноз ТЭЛА 6 месяцев назад. Она лечилась НМГ в течение пяти дней, а затем перешла на ПОАК, которые принимает по сей день. Дополнительно принимает низкие дозы аспирина из-за отягощенного анамнеза по сердечно-сосудистым заболеваниями. Предъявляет жалобы на образование незначительных синяков без выраженного кровотечения.
После завершения основной фазы лечения (3-6 месяцев) следует рассмотреть необходимость продленной антикоагуляции. Это нужно для сравнения риска рецидива (от прекращения лечения) и риска кровотечения (от продолжения антикоагуляции). Если венозная тромбоэмболия была связана с основным преходящим фактором риска, таким как серьезная операция или травма, риск рецидива низкий и составляет 1-3% в течение 10 лет. Однако, если этиология венозной тромбоэмболии не определена, и событие определяется как неспровоцированное, частота рецидивов достигает 25% в течение 10 лет.
Биомаркером рецидива является концентрация Д-димера, измеряемая через 4 недели после прекращения антикоагуляции. Повышенные уровни Д-димера связаны с рецидивом >10%, тогда как нормальные значения предсказывают рецидив <5%. Важным шагом после оценки риска рецидива является оценка риска кровотечения шкала Has-Bleed шкала VTE-Bleed шкала RIETE шкала ACCP . Исследования демонстрируют низкий рецидив среди пациентов, получающих ПОАК в сниженной дозе, без увеличения риска большого кровотечения. Недавний метаанализ 16 исследований продленной терапии показал, что использование ПОАК и АВК значительно снизили риск общей и связанной с ВТЭО смертности на 52% и 64% соответственно без увеличения риска кровотечения среди пациентов, получающих ПОАК.
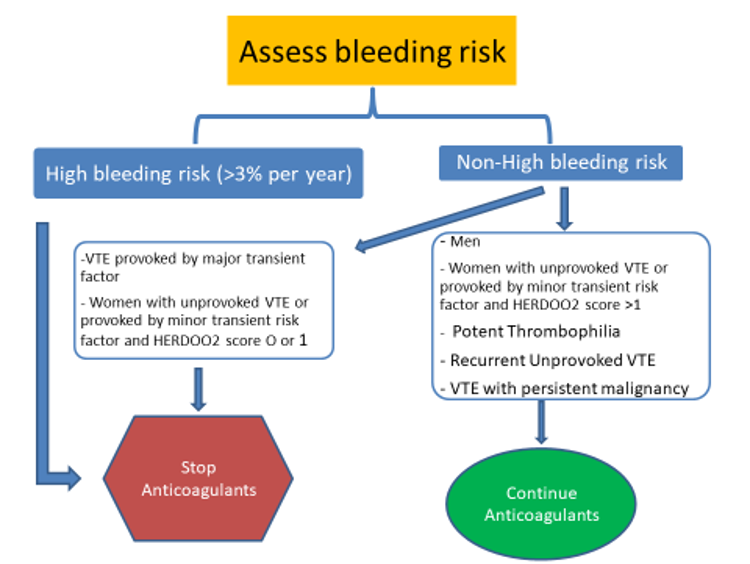
Пациенты с тромбозом, связанным с раком, имеют высокий риск рецидива ВТЭО. Подход к лечению в этой ситуации заключается в продленной АКТ, пока ЗНО активно или продолжается лечение рака. 4 исследования показали не меньшую эффективность ПОАК по сравнению с НМГ. Несмотря на увеличение клинически значимых некрупных кровотечений, особенно у пациентов с желудочно-кишечными и мочеполовыми проблемами, ПОАК значительно улучшают качество жизни у онкологических больных.
Пациентку следует проконсультировать относительно высокого риска рецидива ВТЭО в контексте метастатического рака молочной железы. Учитывая этот риск, ей следует продолжить терапевтическую дозу ПОАК, которая является текущей рекомендацией при тромбозе, связанном с раком. Ей стоит посоветовать прекратить прием аспирина, который не показан и увеличивает риск кровотечения.
Случай № 5: Профилактика рецидива в ситуациях высокого риска
48-летний мужчина направлен на консультацию по поводу профилактики ВТЭО перед артроскопией коленного сустава после спортивной травмы. Десять лет назад у него была ТЭЛА во время госпитализации из-за травмы плеча после несчастного случая на лыжах.
Если в анамнезе пациента есть неспровоцированное ВТЭО или связанное с незначительным преходящим фактором риска, то в период повышенного риска ВТЭО необходимо проводить тромбопрофилактику. Если предыдущее событие было спровоцировано основным преходящим фактором, необходим индивидуальный подход с учетом риска венозной тромбоэмболии и риска кровотечения. Как ПОАК, так и НМГ являются подходящими препаратами для использования в этой ситуации, а в случаях, когда есть противопоказания к их использованию (активное кровотечение или почечная недостаточность), компрессионная терапия и пневматическая компрессия обеспечивают сопоставимую степень профилактики. Для оценки риска ВТЭО у хирургических пациентов используем шкалу Каприни.
Данному пациенту будет проведена процедура с риском тромбоза 1%, но профилактика с использованием ПОАК или НМГ будет уместной.
Заключение
Тромбоз глубоких вен является актуальной проблемой, которая может приводить к серьезным осложнениям вплоть до летального исхода. В связи с чем всем пациентам, находящимся в группе риска, необходимы качественная диагностика, лечение и профилактика. Алгоритмы из данного обзора позволяют проводить тщательный отбор пациентов для последующего исследования на наличие ТГВ и ТЭЛА, подобрать лечение на амбулаторном этапе и в стационаре и определить адекватные методы вторичной профилактики.
Литература
- Martin H. Ellis MD , Orly Avnery MD , DECISION MAKING IN THE MANAGEMENT OF VENOUS THROMBOEMBOLISM, The American Journal of Medicine (2020)
- Wells PS, Ihaddadene R, Reilly A, Forgie MA. Diagnosis of Venous Thromboembolism: 20 Years of Progress. Ann Intern Med. 2018 Jan 16;168(2):131-140
- Mausbach LS, Avnery O, Ellis MH. Ambulatory Versus In-Hospital Treatment of Proximal Lower-Limb Deep Vein Thrombosis in Adults: A Retrospective Cohort Study. Clin Appl Thromb Hemost. 2017 Oct;23(7):859-864.
- Tritschler T, Kraaijpoel N, Le Gal G, Wells PS. Venous Thromboembolism: Advances in Diagnosis and Treatment. JAMA. 2018 Oct 16;320(15):1583-1594
- Kearon C, Kahn SR. Long-term treatment of venous thromboembolism. Blood. 2020 Jan 30;135(5):317-325.
- Neumann I, Izcovich A, Zhang Y, Rada G, Kahn SR, Spencer F, Rezende S, Dentali F, Bauer K, Morgano GP, Yepes-Nuñez JJ, Nieuwlaat R, Wiercioch W, Lu L, Wu J, Cushman M, Schunemann H. DOACs vs LMWHs in hospitalized medical patients: a systematic review and meta-analysis that informed 2018 ASH guidelines. Blood Adv. 2020 Apr 14;4(7):1512-1517




